
在生命最初的旅程中,一个受精卵需要经历一系列精密而复杂的发育阶段,才能最终成长为一个完整的个体。然而,在辅助生殖过程中,许多胚胎在植入子宫前就停止了发育,尤其在8细胞期(8C)阶段,这一发育阻滞现象成为生殖医学领域长期未解的难题。如今,这一难题有了关键线索!

北京时间1月23日凌晨,浙江大学基础医学院/浙江大学医学院附属妇产科医院研究员、长聘副教授梁洪青,浙江大学医学院附属妇产科医院主任医师、教授张丹,联合同济大学高绍荣院士以及浙江大学爱丁堡大学联合学院长聘副教授刘琬璐团队在国际顶尖期刊《科学》发表文章,首次揭示了人类基因组里“远古病毒化石”(内源逆转录病毒,ERV),通过合成特殊的“嵌合RNA”,帮助人类早期胚胎顺利跨越合子基因组激活(ZGA)关键发育节点。该研究不仅深化了对生命起始的理解,也为改善辅助生殖技术提供了新思路。
这也是以浙大妇院为第一单位的研究成果首次登上《科学》杂志。
临床之困——胚胎为何过不了“第三天”这个坎?
“医生,为什么我的胚胎总是刚开始发育就停了?”
在浙大妇院生殖内分泌科的诊室里,张丹经常听到这样的疑问。作为国内顶尖的生殖医学专家,她和团队每年要接待数千个不孕家庭,其中有一些患者会遇到早期胚胎发育阻滞的问题——体外受精形成的胚胎,在发育到受精后第三天(8细胞阶段)时,突然“卡壳”,既不继续分裂,也无法发育为囊胚,最终失去移植价值——这是困扰生殖医学领域多年的“胚胎发育阻滞”难题,也是无数不孕家庭的痛点。
“一开始,我们以为是编码基因出了问题。”张丹回忆道。人类基因组里有2万多个编码基因,就像“生产蛋白质的说明书”,之前的研究大多认为,若这些基因发生突变,可能导致胚胎发育异常。
令人困惑的是,许多发育阻滞的胚胎,通过外显子组测序、家族遗传分析等检查方式,并未发现编码基因有特别异常——染色体没问题,已知的与早期胚胎发育相关的基因突变也未出现,可胚胎就是“活不下去”。“我们无法解释这一现象。这种‘无解’的状态,对医生和患者都是一种煎熬。”张丹说。
这也让研究团队陷入思考:难道基因组里还有未知因素在影响胚胎发育?
与梁洪青团队的碰撞,为这个问题带来了新视角。2019年,长期研究干细胞与转录调控的浙江大学基础医学院研究员梁洪青双聘到浙大妇院,与张丹团队频繁交流学术问题。“基因组里非编码区还有超过40%的 ‘暗物质’——逆转座子序列,其中内源逆转录病毒(ERV)是一个重要的分支。”梁洪青说,ERV是远古病毒感染人类祖先留下的“基因化石”,虽然大多失去了感染能力,但可能在进化中被“驯化”,参与生命活动。
与此同时,研究人员观察到,在人类体外受精胚胎的8细胞“瓶颈期”,胚胎想要继续往下发展,需要一股“洪荒之力”——成功启动自身的基因表达程序,即“合子基因组激活”(ZGA),这样才能实现从依赖卵子储存的母源物质到激活自身基因组的切换。ZGA如同生命启动的“总开关”,一旦失败,胚胎发育便会阻滞于此。
“已知的、负责编码蛋白质的基因中,仅有少数几十个被发现与早期胚胎发育调控直接相关。对于大量临床上找不到编码基因突变的发育阻滞案例,我们推测,问题的答案可能隐藏在占据基因组绝大部分、功能未知的‘非编码区’。”张丹解释道。
临床的迫切需求与基础研究的探索在此交汇,双方都觉得这是一个很有意思也很有想象力的好问题。团队决定从合子基因组阶段特异性高表达的ERV入手,对比正常胚胎和发育阻滞胚胎的差异。结果令人惊喜:在发育阻滞的8细胞胚胎中,ERV家族里的MLT2A1的亚家族,表达量比正常胚胎显著下调!“这似乎找到一个关键线索——MLT2A1的‘缺席’,可能正是胚胎‘卡壳’的原因。”梁洪青说,由此,团队锁定了进一步的研究目标:探索MLT2A1如何影响胚胎发育。
创新突破——“远古病毒化石”的变身记,解锁胚胎启动的3大密码
要弄清楚MLT2A1的作用,首先得看清它在胚胎里“做什么”。但传统的测序技术,就像把RNA剪成碎片再拼接,很难完整捕捉MLT2A1的真实形态。团队采用了纳米孔长读长测序技术——相当于给RNA拍“全身照”,能完整读出它的序列,不遗漏细节。
该技术的应用带来了第一个重大发现:MLT2A1在ZGA阶段并非孤立地表达自己,而是主动地与下游各种不同的基因组序列“手拉手”融合,形成了一系列结构特殊的“嵌合RNA”。
“这彻底颠覆了我们的认知。”论文共同第一作者、浙大妇院博士后向阳泉感叹,“就像一把钥匙,原本只有一种齿形,却能搭配不同的‘齿套’,变成无数种钥匙。”研究结果显示,MLT2A1的“主体”是固定的,但会和下游的编码基因、非编码序列,甚至其他逆转座子融合。研究人员在人类8细胞期胚胎和干细胞中鉴定出几百种不同的嵌合转录本,这些嵌合RNA平均长度在500-1000碱基之间,绝大多数通过剪接事件连接而成。
这意味着,MLT2A1通过这种广泛的“嵌合”模式,极大地拓展了其RNA序列的复杂性和多样性。原本只有3800多种相似“钥匙”,现在变成了能打开基因组中成千上万把不同“连环锁”的“万能钥匙串”。
那么,这些“嵌合RNA”如何具体行使功能?研究团队揭开了第二个关键机制:MLT2A1 RNA主要富集在细胞核内。在同济大学高绍荣院士的支持下,团队揭示了它们利用其嵌合特性,能够精准地靶向并结合到基因组上大量与ZGA相关的位点。
更关键的是,MLT2A1 RNA并非“单打独斗”。它通过其保守的序列区域,招募了一个重要的核内蛋白“帮手”——HNRNPU。两者形成的复合物,又能进一步招募负责基因转录的“核心机器”——RNA聚合酶II。
团队成员打了一个比方,MLT2A1嵌合RNA就像一个高效的“协调员”。它凭借“嵌合体”带来的多样性,精准定位到基因组上需要被激活的ZGA基因位点“施工现场”,然后利用其保守部分,“招募”来HNRNPU蛋白“项目经理”和RNA聚合酶II“施工队”,从而高效启动这些关键基因的转录。这就像是搭建了一座直接通往基因激活的“立交桥”。
MLT2A1的调控机制还体现出了高度的协同性与稳定性。团队发现,散布在基因组各处的数千个MLT2A1拷贝并非各自为政,而是形成了一个相互促进、相互激活的“互助网络”。
当研究人员敲低单个高表达的MLT2A1拷贝时,不仅该拷贝自身表达下降,其他多个MLT2A1拷贝的表达也受到牵连,导致整个亚家族的表达水平如多米诺骨牌般进一步降低。反之,过表达MLT2A1嵌合RNA则能提升整体家族的活性。
“它们就像一组紧密咬合的‘命运齿轮’,”张丹形容,“一个齿轮转动,会带动周围所有齿轮一起转动。这种自我放大和集体行动的机制,确保了在ZGA这个关键时间窗口,能够快速、强劲地启动全局性的基因表达程序,帮助胚胎顺利跨越发育瓶颈。”
为了验证这一机制,团队用了临床废弃的三原核胚胎做实验:人为降低MLT2A1的表达,胚胎果然发生了阻滞;而补充体外合成的MLT2A1嵌合RNA后,胚胎的ZGA程序又能重新启动。“这证明MLT2A1不是‘旁观者’,而是胚胎发育的‘关键开关’。”梁洪青说。
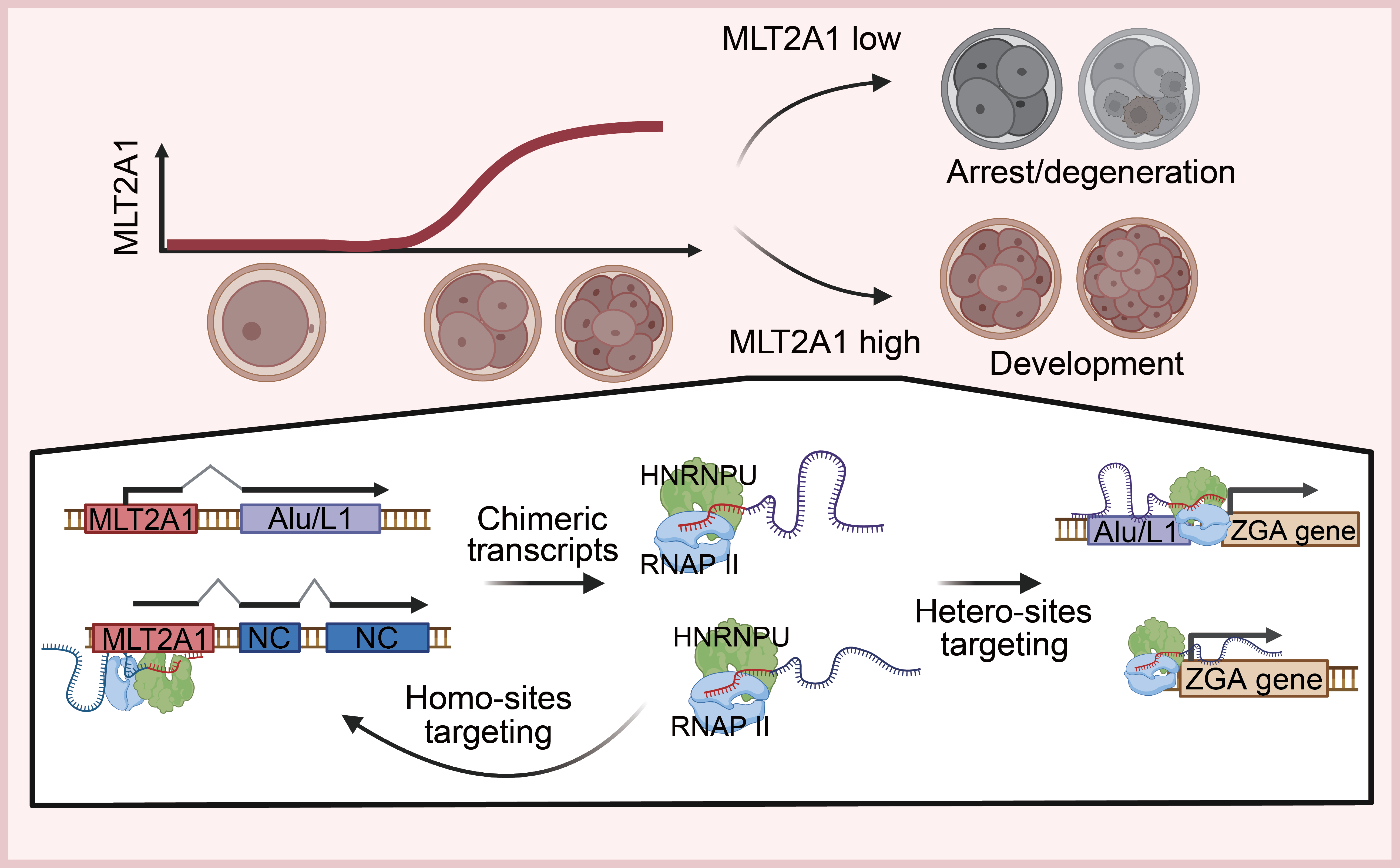
MLT2A1 亚家族逆转座子调控胚胎合子基因组激活的示意图
价值深远——不止于“读懂”胚胎,更打开生殖健康新视野
从门诊中碰到早期胚胎发育阻滞的病例,到临床与基础研究团队互相启发擦出创新的火花,在张丹和梁洪青看来就像是一个侦探破案的过程,“浙江大学和浙大妇院都有着交叉创新与开放合作的科研氛围,不同研究背景的专家是真正的‘人在一起’地工作,扩大了各自的研究领域。”
而这项融合了基础和临床的研究,意义也是多重的。
首先,它深化了我们对生命起始的理解。研究首次令人信服地揭示了,曾被忽视的基因组“暗物质”——内源逆转录病毒,在人类生命最初的塑造过程中,扮演了积极主动且至关重要的角色,为发育生物学提供了全新的认知视角。
“生命的演化是高效而智慧的。它‘驯化’了这些古老的病毒序列,将其转化为胚胎突破第一个发育难关的关键工具。这项研究让我们看到了生命设计的精妙与深奥。”梁洪青感慨。
其次,它为改善辅助生殖技术提供了全新的科学思路和潜在的未来路径。
一方面,MLT2A1的表达水平有望成为一种新型的生物标志物,用于评估IVF胚胎的发育潜能。“目前,我们筛选胚胎主要依靠形态学观察,好比‘以貌取人’,有其局限性。”张丹表示,“未来,如果能通过对MLT2A1等分子的检测,更早、更精准地预测胚胎活力,或可有助于我们筛选出最优质的胚胎进行移植,从而提高试管婴儿的成功率。”
另一方面,这项研究为理解并干预因ZGA失败导致的胚胎发育阻滞奠定了一定的理论基础。“它为我们指明了新的探索方向:除了编码基因,非编码区域尤其是逆转座子的调控至关重要,”张丹补充,“这提示我们,未来或许可以通过优化体外培养体系,模拟更接近体内的环境,来更好地支持胚胎自身基因组的激活程序,帮助更多胚胎顺利发育。”
在此研究成果的启发下,团队帮助外地一位之前不明原因自发流产、三次试管婴儿不成功的患者调整治疗方案后成功受孕,目前患者已经妊娠23周。当然,研究人员也强调,从基础研究的创新突破到临床应用的完全落地尚有很长的路要走。未来,浙大妇院的研究团队将继续深入研究,努力为众多遭受不明原因胚胎发育阻滞困扰的家庭提供未来希望。
浙江大学医学院附属妇产科医院向阳泉、钱羽力、李铮一、王佳旭为共同第一作者。本研究受国家重点研发计划、国家自然科学基金、浙江省科技厅“领雁”项目等项目资助。
文字:李晟曈 吴雅兰

浙公网安备 33010202000574号
版权所有:浙江大学医学院附属妇产科医院 浙ICP备05080900号-1
Copyright © 2016 Women's Hospital School Of Medicine Zhejiang University